News & Media
펠레메드, 저분자화합물 발굴 ‘펠레셀렉트’ 장점은?
작성자
user
작성일
2021-08-23 16:47
조회
693

활성화 카이네이즈 타깃 플랫폼 ‘펠레셀렉트’ 기반 내성극복 “新기전 항암제 개발”..신규 표적 타깃 삼중저해제 ‘PLM-101’, 이중저해제 ‘PLM-102’ 개발
김용철 펠레메드 대표는 “자체 개발한 저분자화합물 신약발굴 플랫폼을 이용해 신규 항암제 표적 후보물질을 발굴하고, 이를 통해 기존 치료제에 내성을 나타내는 종양의 치료가 가능하고 내성발생 위험이 낮은 새로운 기전의 항암제를 개발할 것”이라고 말했다.
펠레메드의 신약발굴 플랫폼인 펠레셀렉트(PeLeSeLect)는 △활성화된 카이네이즈(kinase)의 구조를 예측한 데이터베이스와 △카이네이즈에 결합하는 물질의 데이터베이스(ligand database)로 구성돼 있으며, 이를 통해 활성화된 카이네이즈의 ATP 결합 부위를 타깃하는 신약을 개발해 약물내성을 극복한 항암제를 개발한다.
펠레(Pele)는 ‘기적’을 의미하는 히브리어로 펠레셀렉트는 기적의 약물을 찾아내고자 하는 뜻을 담아 이름지었다.
펠레셀렉트를 통해 발굴한 선도 파이프라인 ‘PLM-101’은 기존 치료제에 내성을 나타낸 비소세포폐암(NSCLC), 유방암 등 고형암을 대상으로 개발 중이다. 특히 아스트라제네카(Astrazeneca)의 표적항암제인 EGFR 저해제 ‘이레사(Iressa, gefitinib)’나 ‘타그리소(Tagrisso, osimertinib)’ 등 기존치료제에 불응하는 환자들을 타깃한 non-EGFR kinase 저해제를 우선 개발한다는 전략이다.
두번째 파이프라인 PLM-102는 기존 치료제에 내성을 가진 급성골수성백혈병(AML)을 타깃해 연구 중이다. 기존 치료제보다 타깃 저해효과가 높고, 안전성 측면에서 장점이 있을 것으로 기대하고 있다.
PLM-101은 올해 5월 한국과 호주에서, PLM-102는 지난 7월 한국에서 특허 등록을 완료했다.
이외에도 펠레메드는 과민성방광질환 및 발기부전 치료제 후보물질 ‘PLM-201’, 자가면역질환치료제 후보물질 ‘PLM-301’, 면역항암제 후보물질 ‘PLM-105’, B형간염(HBV) 치료제 후보물질 ‘PLM-401’의 개발을 진행 중이다.
펠레메드는 지난 2019년 5월 김용철 광주과학기술원(GIST) 교수가 설립했다. 김용철 대표는 신약발굴(discovery) 총괄하고 있으며, 애니젠(Anygen)에서 2001~2016년까지 CTO로 근무하며 신약 발굴 및 비임상/임상개발 경험을 보유하고 있다. 또 한명의 각자대표인 장수연 대표는 신약개발(development) 및 경영을 총괄하며, 애니젠에서 2013~2018년까지 기술성평가와 상장을 주도한 경험을 가지고 있다.
펠레메드는 현재 연구인력 3명을 포함 총 9명으로, 올해 내 3명의 연구인력을 충원하는 등 계속해 연구인력을 모집할 계획이다. 펠레메드는 지난해 12월 시리즈A로 65억원의 투자를 유치했으며, 올해말에서 내년초 시리즈B 투자유치를 진행할 계획이다.
◆ 약물발굴 플랫폼 ‘펠레셀렉트’..”활성화 카이네이즈 ATP 결합부위 타깃 내성극복 항암제 개발 “
펠레메드의 펠레셀렉트는 기존에 승인되거나 개발 중인 240여개 항암제 리간드 데이터베이스(ligand database)와 활성화 카이네이즈 구조를 분석한 데이터베이스를 이용해 활성화 카이네이즈 단백질의 ATP 결합부위를 타깃하는 신약 후보물질을 발굴하는 기술이다. 펠레메드는 약물 표적으로 적용 가능한 25종의 카이네이즈와 이에 결합할 수 있는 7만5000개의 리간드 데이터베이스를 구축했다.
종양세포에서 특정 카이네이즈는 활성화되면 인산화 과정을 거쳐 세포내 신호전달 과정을 활성화하고 암세포의 성장을 촉진한다. 이런 활성화 카이네이즈의 ATP 결합부위에 다른 물질이 결합하게 되면 카이네이즈가 비활성화돼 신호전달 과정이 억제되면서 종양성장이 억제되는 기전이다.
카이네이즈를 타깃하는 항암제는 카이네이즈 단백질이 활성화가 되기전에 특정 부위에 결합하는 타입2 항암제와 활성화나 돌연변이로 인해 구조적인 변화가 생긴 후 ATP 결합부위를 타깃해 카이네이즈 활성을 낮추는 타입1 항암제로 구분된다.
펠레메드는 신규 표적 카이네이즈의 ATP 결합부위 중 활성화루프(activation loop)와 탈인산화부위(phosphate pocket)을 타깃한 약물을 개발하고 있다. 이 부분은 ATP가 결합하는 부위로 카이네이즈 활성을 조절하기 때문에 돌연변이가 발생할 확률이 낮아 내성발생 위험(risk)이 낮다.
이런 펠레셀렉트를 이용한 신약후보물질의 장점은 무엇일까? 먼저 기존에 사용되던 표적항암제나 면역항암제의 단점을 극복할 수 있는 신규 표적을 타깃하는 약물 후보물질을 발굴한다는 것이다. 먼저 아스트라제네카의 표적항암제인 EGFR 저해제 ‘이레사(Iressa, gefitinib)’나 ‘타그리소(Tagrisso, osimertinib)’ 등은 타입1 항암제지만 ATP subpocket(gatekeeper) 부위에 결합하기 때문에 돌연변이가 발생시 종양이 내성을 획득할 수 있으며, 이렇게 재발할 경우 치료옵션이 제한된다(doi:10.1007/978-3-030-48283-1_2). 면역항암제도 낮은 반응률을 보이는 한계가 있어, 머크(MSD), BMS 등의 글로벌 제약사는 반응률을 높이기 위해 다른 약물과 병용하는 임상을 진행하고 있다.
◆ 삼중작용기전 ‘PLM-101’..”기존 치료제 내성 암세포주와 동물모델서 항암효과 보여”
펠레메드의 선도파이프라인은 획득내성 암환자에게 주로 과발현된 유전자들을 타깃하고 있는 삼중작용기전의 PLM-101으로 현재 획득내성을 가진 폐암, 유방암 등 고형암을 대상으로 개발 중이다.
내성은 크게 획득내성과 돌연변이 내성으로 구분할 수 있는데, 획득내성은 약물의 표적이 되는 카이네이즈를 발현하지 않는 암종이 생기면서 기존 약물에 저항성을 나타내는 것을 의미한다. 돌연변이 내성은 약물 표적부위의 돌연변이로 인해 약물이 결합하지 못해 저항성을 가지게 된다. 예를 들어 EGFR 저해제를 지속적으로 사용한 암환자의 경우 어느순간 EGFR을 발현하지 않는 암세포가 나타나는데 이것이 획득내성이고, EGFR 저해제 결합부위에 돌연변이가 일어나 저항성을 나타내는 경우가 돌연변이 내성이다.
펠레메드는 기존 획득내성 암환자에게서 주로 과발현되어 있고 암의 전이를 조절하는 것으로 알려진 유전자 2종과 항암제 표적으로 잘 알려져 있는 RET을 동시에 타깃하는 삼중작용기전의 PLM-101을 개발 중이다. 예를 들어 PLM-101이 타깃하는 유전자 중 하나는 타그리소에 저항성을 나타내는 비소세포폐암(NSCLC) 환자의 약 20%에서 발현된다.
김 대표는 “PLM-101은 임상적으로 획득내성을 가진 여러 종양환자에게서 겹치는 유전자를 타깃으로 하고 있다”며 “PLM-101의 타깃이 임상적으로 획득내성 종양과 관련있다는 논문들이 보고되어 있어 신속하게 개발을 진행 중”이라고 말했다.
또다른 타깃인 RET은 갑상선암, 폐암, 췌장암 등에서 과발현되고 있는 표적으로 알려져 있다. 폐암환자의 경우 약 2%, 췌장암에서는 약 50~60%, 유방암에서는 약 30~70%가 발현된다.
현재 승인받은 RET 저해제는 일라이릴리(Eli lilly)의 ‘레테브모(Retevmo, selpercatinib)’와 로슈(Roche)의 ‘가브레토(Gavreto, pralsetinib)’로 두 약물 모두 지난해 미국 식품의약국(FDA)에서 가속승인받았다. 릴리의 레테브모는 RET 융합양성 비소세포폐암(NSCLC) 환자에게 1차치료제로 사용했을 경우 ORR 85%로 부분반응(PR) 85%, 이전에 치료받은 경험이 있는 환자에게서는 ORR 64%로 완전관해(CR) 1.9%, 부분반응(PR) 62%의 결과를 나타냈다.
로슈의 가브레토는 이전에 백금기반 화학요법으로 치료받은 경험이 있는 RET 융합양성 비소세포폐암(NSCLC)환자에게서 전체반응률(ORR) 57%, 완전관해(CR) 5.7%의 결과를 나타냈다. 치료받은 경험이 없는 환자에게서는 ORR 70%, 완전관해 11%의 결과를 보였다.
펠레메드가 개발 중인 PLM-101의 동물모델 연구 결과를 살펴보자. 먼저 펠레메드는 기존 항암제에 불응한 유방암 환자를 대상으로 유전자 발현을 분석했다. 그 결과 PLM-101 타깃 유전자의 발현이 높은 경우(high expression) 낮은 환자(low expression)들에 비해 생존률이 감소한 결과를 확인했다.
실제 펠레메드는 이레사와 타그리소에 내성을 보이는 폐암 세포주에 PLM-101을 투여한 결과 약물의 용량의존적으로 항암효과가 증가하는 결과를 확인했다. 또 유방암 치료제로 사용되는 ‘타목시펜(Tamoxifen)’에 내성을 보이는 MCF-TAMR 세포주와 폐암세포주인 PC9, Calu-1에 PLM-101을 투여하면 종양전이가 억제된 결과를 보였다. PLM-101 40mg/kg을 투여한 타목시펜 내성 세포주를 이식한 마우스 모델에서는 종양세포의 크기가 감소했다.
펠레메드는 현재 BIG3 중소벤처기업 혁신성장 지원사업을 바탕으로 PLM-101의 비임상 연구를 진행 중으로 내년 글로벌 임상시험계획(IND) 신청을 목표로 하고 있다.
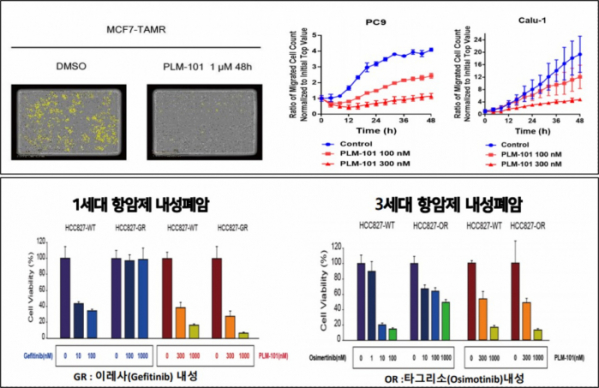
▲세포주에서 PLM-101 항암효과 결과(펠레메드 자료 참조)
펠레메드의 또다른 내성획득 종양 타깃 파이프라인은 이중작용기전의 PLM-102다. PLM-102는 급성골수백혈병(AML)을 앓고 있는 환자 중 약 30%에서 나타나는 유전자 돌연변이와 RET을 동시에 저해하는 기전이다.
기존 급성골수성백혈병(AML) 환자에게 사용되는 치료제의 경우 카이네이즈의 다양한 부위에 내성 돌연변이가 발생하기 때문에 이를 억제하는 새로운 기전의 약물에 대한 미충족의료수요가 있다(doi:10.1111/cas.14274). 특히 급성골수성백혈병은 5년내 생존률이 50%에 불과하며 치료 후 재발할 경우 예후가 좋지 않다.
기존 연구결과를 살펴보면, PLM-102가 타깃하는 유전자와 RET 발현이 높은 급성골수성백혈병 환자들은 전체생존기간(OS)이 감소했다(doi:10.1371/journal.pone.0089560; doi:10.3892/ol.2015.3644). RET 발현이 높은 환자군은 낮은 환자군과 비교해 전체생존기간 중앙값(mOS)이 각각 22개월, 35개월로 나타났다. 또 무재발생존기간(relapsed-free survival, RFS)은 RET 발현이 높은 경우 22개월로 낮은 경우는 32개월이었다.
PLM-102의 또다른 타깃유전자의 돌연변이가 발생한 경우 전체생존기간 중앙값(mOS)은 11.8개월, 이중돌연변이가 발생한 경우에는 8.4개월로 정상형 27.7개월에 비해 감소했다. 무재발생존기간(RFS)은 이중돌연변이가 발생한 경우 5.2개월로 정상형 23.7개월 대비 짧은 기간에 재발한 결과를 나타냈다.
펠레메드는 PLM-102를 종양 마우스모델에 5mg/kg, 10mg/kg, 20mg/kg 투여한 결과 용량의존적으로 종양크기가 감소했으며, 모든 용량에서 체중감소가 나타나지 않은 결과를 확인했다. 김 대표는 “PLM-102는 기존에 승인받은 경쟁약물 대비 타깃 유전자 저해효과가 우수하고 위/장관의 pH변화에 따른 용해도로 위장과 십이지장 상부에서만 흡수되는 특성을 가지고 있다”며 “기존 약물보다 안전성 측면에서 장점이 있을 것으로 기대하고 있다”고 말했다.
현재 PLM-102는 보건복지부의 바이오헬스케어 과제에 선정됐으며, 2023년까지 비임상연구를 진행해 PLM-101의 뒤를 있는 파이프라인으로 개발할 계획이다.
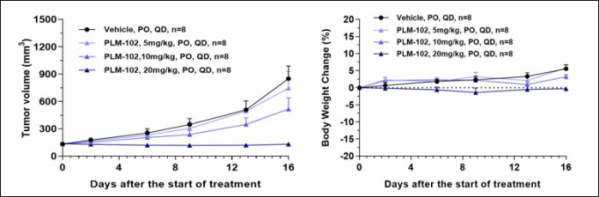
▲PLM-102 결과(펠레메드 자료 참조)
◆ 펠레메드의 후속 파이프라인은?
펠레메드는 과민성방광질환 치료제 후보물질 ‘PLM-201’, 천연물 기반의 아토피피부염 치료제 후보물질 ‘PLM-301’과 인공지능(AI)을 이용해 발굴한 B형간염(HBV) 치료제 후보물질 ‘PLM-401’, 면역항암제 ‘PLM105’ 등을 개발 중이다.
기존 과민성방광질환 치료제로 사용되던 아세틸콜린 M3 수용체 길항제는 방광확장, 구갈, 변비 등의 부작용으로 인해 투여중단 및 복약순응도가 떨어지는 단점이 있는 반면 PLM-201은 평활근 이완작용을 통해 부작용을 줄여 복양순응도를 높일 수 있을 것으로 펠레메드는 기대하고 있다.
실제로 펠레메드는 과민성방광질환 동물모델에 PLM-201을 투여한 결과 소변 배출이 유의미하게 감소한 결과를 확인했다.
PLM-301은 아토피피부염을 대상으로 개발중인 천연물 기반 치료제 후보물질이다. T세포의 분화를 조절해 과도한 면역반응을 정상화하고, 염증성 사이토카인의 분비를 억제하는 컨셉이다. 특히 펠레메드는 PLM-301을 아토피 동물모델에 경구투여한 결과 아토피피부염 심각도지표(clinical severity index)가 유의미하게 감소하고, 조직학적 이상도 개선된 결과를 확인했다. 또, 혈액내 사이토카인 수치와 T세포 분포도 개선됐다.
다음으로 PLM-401은 HBV 치료제 후보물질로 HBV의 캡시드 합성에 관여하는 기전을 억제해 항바이러스 효과를 내는 컨셉이다. 펠레메드는 1095개의 신규물질을 스크리닝해 활성 및 대사 안전성이 높은 134개의 후보물질을 발굴했다. 현재 PLM-401을 투여한 HBV 모델동물은 HBV DNA가 감소하고, 2주간의 예비독성연구(non-GLP)에서 독성이 관찰되지 않았다.
마지막으로 PLM-105는 경구용 저분자화합물로 기존 면역관문억제제에 불응하거나 저항성을 보이는 환자에게서 반응성을 높일 수 있을 것으로 기대하고 있다. 김 대표는 “현재 펠레메드의 과학자문위원(SAB)으로 박한수 지놈앤컴퍼니 대표겸 GIST 교수가 합류해있다”며 “지놈앤컴퍼니와 공동개발 중인 파이프라인으로 신규 타깃을 표적으로 하고 있다”고 말했다.
저분자화합물 기반의 면역항암제 개발은 이번이 처음이 아니다. BMS, 쿄와기린, 미국 머크(MSD) 등 글로벌 제약사들은 IDO1(indoleamine-2,3 dixygenase1)을 타깃으로 항암제 개발을 진행했다. IDO1은 트립토판 대사에 관여하는 효소로 다양한 병원균(pathogen)에 대한 면역반응에 관여하는데 특히 면역관용(immune tolerance)을 통해 T세포를 억제하는 것으로 알려져있다. BMS는 IDO1 저해제 ‘BMS-986205’와 옵디보를 병행해 방광암, 비소세포폐암, 흑색종 등을 대상으로 하는 다양한 임상을 진행 중이다. 또 쿄와기린(Kyowa Kirin)은 IDO1 저해제 ‘KHK2455’와 ‘바벤시오(Bavencio, avelumab)’를 병용해 방광암에 대한 임상 1상(NCT03915405)을 진행하고 있다(doi:10.1186/s13045-021-01080-8).
IDO 저해제인 ‘에파카도스타트(epacadosatat)’는 인사이트(Incyte)와 미국 머크(MSD)가 전이성 흑색종을 대상으로 키트루다와 병용해 임상 3상(NCT02752074)을 진행했으나 무진행생존기간(PFS) 및 전체생존기간(OS)를 개선하지 못했다(doi:10.1016/S1470-2045(19)30274-8). 이외에도 에파카도스타트를 이용한 수십개의 임상이 진행됐으나 낮은 환자모집률과 안전성 등을 이유로 임상을 중단하는 등 개발에 어려움을 겪고 있다(doi:10.1186/s13045-021-01080-8).
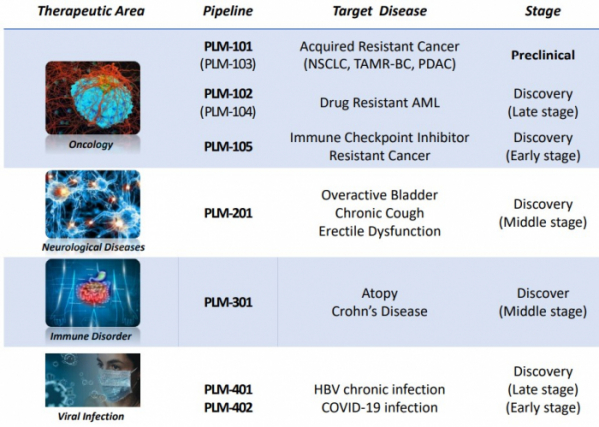
▲펠레메드 파이프라인(펠레메드 자료 참조)
서윤석 기자 yoonseok.suh@bios.co.kr
<저작권자 © 바이오스펙테이터 무단전재 및 재배포 금지>
원본기사 확인 http://biospectator.com/view/news_view.php?varAtcId=13943


